Возникновение аэробного метаболизма у древних организмов принесло им не только выгоды в виде более эффективного метаболизма, но и проблемы, связанные с особенностями строения молекулы кислорода.
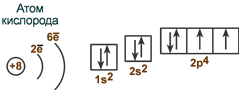
Порядковый номер кислорода в таблице Менделеева – 8, заряд ядра – +8, общее число электронов – 8, электронная формула кислорода – 1s22s22p4. На 2р-подуровне атома имеются два неспаренных электрона, обычное для кислорода окислительное число равно -2.
 |
 |
Диаграмма строения атома кислорода |
Строение молекулы кислорода |
Молекула кислорода в своем обычном состоянии отличается от других газообразных элементов тем, что имеет два неспаренных электрона, т.е. является бирадикалом. В целом, общие механизмы восстановления кислорода в биохимических реакциях происходят с участием только одного электрона, а кислород является довольно стабильной молекулой, обладающей свойством сильного окислителя.
Упомянутые неспаренные электроны обладают параллельными спинами. Это, в соответствии с принципом Паули, выдвигает условие, что с кислородом могут взаимодействовать только такие двухвалентные восстановители, которые имеют два неспаренных электрона с параллельными спинами, но спины приносимых электронов должны быть противоположны имеющимся в кислороде.
Поскольку каждая молекула кислорода имеет два неспаренных электрона на внешней орбитали, то в клетке она легко вовлекается в реакции, связанные с захватом "недополученных" электронов, и в итоге восстанавливается до воды, конечного продукта биологического окисления. В идеальном мире именно так и происходит. Однако в реальности часто образуются продукты неполного восстановления кислорода, называемые активные формы кислорода (АФК). АФК являются нестабильными молекулами, что и определяет их высокие реакционные свойства.

Активные формы кислорода
Кроме активных радикалов кислорода существуют и другие реактивные молекулы.

