Основными факторами, влияющими на обмен железа, являются потребности гемопоэза, пищевой фактор и уровень запаса металла в тканях. Количество железа в организме поддерживается тремя основными путями:
1. Регуляция всасывания в кишечнике.
2. Поддержание рециркуляции железа эритроцитов.
3. Регуляция количества поступающего в клетку железа.
Гепсидин и его функции
Среди белков-регуляторов обмена железа к настоящему времени наиболее хорошо изучен гепсидин (hepcidin), олигопептид из 25 аминокислот.
В норме гепсидин синтезируется в печени при достаточном количестве железа в гепатоците и особенно при его перегрузке железом. Эффектом пептида в клетках-мишенях является интернализация и деградация белка ферропортина, отвечающего за выход ионов железа в кровь:
- в энтероците действие гепсидина приводит к тому, что большая часть железа остается в клетке, запасается в ферритине и теряется при слущивании кишечного эпителия,
- при действии гепсидина на макрофаги и гепатоциты происходит задержка железа внутри этих клеток.
При патологических состояниях гепсидин повышается в крови на фоне воспалительных процессов и бактериальных инфекций, т.к. он является белком острой фазы. Усиление его синтеза происходит под действием провоспалительных цитокинов (IL-6, IL-1α, TNF-α), наиболее эффективным из которых является интерлейкин-6. Образующийся избыточный гепсидин, уровень которого при бактериальной или вирусной инфекции может повышаться в десятки и сотни раз (!), блокирует выход железа в кровь из энтероцитов (т.е. происходит подавление всасывания), выход в кровь из макрофагов и гепатоцитов (удержание железа в клетках). В результате развивается гипоферремия. Недостаток железа в крови приводит к снижению эритропоэза – развивается "анемия воспаления" ("анемия хронических заболеваний").
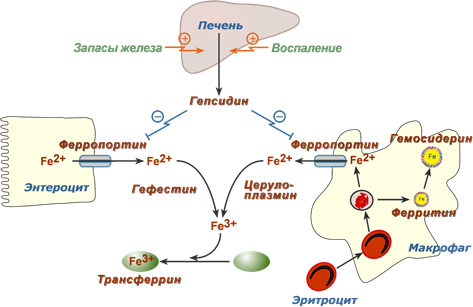
Действие гепсидина на обмен железа
Система IRE/IRP
Регуляцию поступления железа в клетку обеспечивает система IRE/IRP (англ. IRE, iron-responsive element - железочувствительный элемент и IRP, iron-responsive element-binding proteins - белок, связывающийся с железочувствительным элементом). Основой регуляции является наличие особого участка на матричной РНК, а именно железочувствительного элемента IRE, связывающего специфичный к нему белок IRP.
В данном случае используется способность молекул IRP связываться с участком IRE соответствующих мРНК для двух белков – рецепторов трансферрина и ферритина. При этом в комплексе с железом IRP не активен и не присоединяется к мРНК, без железа - может присоединяться.
1. Присоединение IRP к мРНК рецептора трансферрина ближе к ее 3'-концу защищает мРНК от разрушения РНКазами, действующими с 3'-конца мРНК:
- при низкой концентрации железа в клетке белок IRP является активным, присоединяется к мРНК и, как следствие, мРНК рецепторов трансферрина существует дольше, образуется больше белков-рецепторов и повышается поток железа в клетки.
- при высоком содержании железа в клетке белок IRP присоединяет железо, становится неактивным, с мРНК связаться не может и, соответственно, не защищает ее от разрушения. Синтез рецепторов к трансферрину не происходит, дополнительное железо клеткой не захватывается.

Регуляция синтеза рецепторов к трансферину
2. Взаимодействие IRP с мРНК ферритина происходит ближе к 5'-концу, т.е. там где начинается трансляция:
- при низком содержании железа в клетке присоединение "пустого" активного белка IRP к мРНК для ферритина со стороны 5'-конца не позволяет ей участвовать в процессе трансляции и синтезе новых молекул ферритина,
- когда концентрация железа в клетке возрастает, оно присоединяется к IRP, снижает его сродство к мРНК и позволяет синтез ферритина.

Регуляция синтеза ферритина
Конечным результатом при наличии железа в клетке является исчезновение рецепторов к трансферрину с мембраны и увеличение синтеза молекул ферритина, депонирующего железо. При отсутствии железа активируется синтез рецепторов к трансферрину и захват железа из крови, и подавление синтеза запасающего белка ферритина.
