Свойства ферментов
1. Зависимость скорости реакции от температуры
Зависимость активности ферментов (скорости реакции) от температуры описывается колоколообразной кривой с максимумом скорости при значениях оптимальной температуры для данного фермента. Повышение скорости реакции при приближении к оптимальной температуре объясняется увеличением кинетической энергии реагирующих молекул.
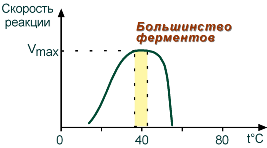
Зависимость скорости реакции от температуры
Закон о повышении скорости реакции в 2-4 раза при повышении температуры на 10°С справедлив и для ферментативных реакций, но только в пределах до 55-60°С, т.е. до температур денатурации белков. При понижении температуры активность ферментов понижается, но не исчезает совсем.
Классическим примером является фермент аденилаткиназа, выдерживающая температуру 100ªС при рН равном 1,0.
Ферменты могут быть очень чувствительны к изменению температуры:
- у сиамских кошек мордочка, кончики ушей, хвоста, лапок черного цвета. В этих областях температура всего на 0,5°С ниже, чем в центральных областях тела. Но это позволяет работать ферменту, образующему пигмент в волосяных луковицах, при малейшем повышении температуры фермент инактивируется,
- обратный случай - при понижении температуры окружающего воздуха у зайца-беляка пигментообразующий фермент инактивируется и заяц получает белую шубку,
- противовирусный белок интерферон начинает синтезироваться в клетках только при достижении температуры тела 38°С,
Бывают и уникальные ситуации:
- для большинства людей повышение температуры тела на 5°С (до 42°С) несовместимо с жизнью из-за дисбаланса скорости ферментативных реакций. В то же время у некоторых спортсменов обнаружено, что при марафонском беге их температура тела составила около 40°С, максимальная зарегистрированная температура тела была 44°С.
2. Зависимость скорости реакции от рН
Зависимость также описывается колоколообразной кривой с максимумом скорости при оптимальном для данного фермента значении рН.
Данная особенность ферментов имеет существенное значение для организма в его адаптации к изменяющимся внешним и внутренним условиям. Сдвиги величины рН вне- и внутри клетки играет роль в патогенезе заболеваний, изменяя активность ферментов разных метаболических путей.
Для каждого фермента существует определенный узкий интервал рН среды, который является оптимальным для проявления его высшей активности. Например, оптимальные значения рН для пепсина 1,5-2,5, трипсина 8,0-8,5, амилазы слюны 7,2, аргиназы 9,7, кислой фосфатазы 4,5-5,0, сукцинатдегидрогеназы 9,0.
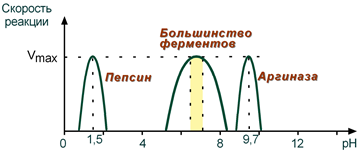
Зависимость скорости реакции от величины pH
Зависимость активности от кислотности среды объясняется наличием аминокислот в структуре фермента, заряд которых изменяется при сдвиге рН (глутамат, аспартат, лизин, аргинин, гистидин). Изменение заряда радикалов этих аминокислот приводит к изменению их ионного взаимодействия при формировании третичной структуры белка, изменению его заряда и появлению другой конфигурации активного центра и, следовательно, субстрат связывается или не связывается с активным центром.
Изменение активности ферментов при сдвиге рН может нести и адаптивные функции. Так, например, в печени ферменты глюконеогенеза требуют меньшей рН, чем ферменты гликолиза, что удачно сочетается с закислением жидкостей организма при голодании или физической нагрузке.
Для большинства людей сдвиги величины рН крови за пределы 6,8-7,8 (при норме 7,35-7,45) несовместимы с жизнью из-за дисбаланса скорости ферментативных реакций. В то же время у некоторых марафонцев обнаружено снижение рН крови в конце дистанции до 6,8-7,0. И ведь при этом они сохраняли работоспособность!
3. Зависимость от количества фермента
При увеличении количества молекул фермента скорость реакции возрастает непрерывно и прямо пропорционально количеству фермента, т.к. большее количество молекул фермента производит большее число молекул продукта.
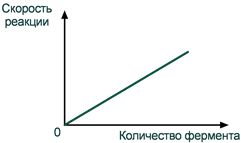
Зависимость скорости реакции
от количества фермента
4. Зависимость скорости реакции от концентрации субстрата
При увеличении концентрации субстрата скорость реакции сначала возрастает, т.к. к катализу добавляемых молекул субстрата подключаются новые и новые молекулы фермента. Т.е. скорость накопления продукта возрастает, и это означает увеличение активности фермента. Затем наблюдается эффект насыщения (плато на кривой), когда все молекулы фермента заняты молекулами субстрата и непрерывно ведут катализ, здесь скорость реакции максимальна. В некоторых случаях, при дальнейшем увеличении концентрации субстрата между его молекулами возникает конкуренция за активный центр фермента и активность фермента (скорость реакции) снижается.

