В медицине активно разрабатываются и используются соединения, изменяющие активность ферментов с целью регуляции скорости метаболических реакций и уменьшения синтеза определенных веществ в организме.
Подавление активности ферментов обычно называют ингибированием, однако это не всегда корректно. Ингибитором называется вещество, вызывающее специфичное снижение активности фермента. Таким образом, неорганические кислоты и тяжелые металлы ингибиторами не являются, а являются инактиваторами, так как снижают активность многих ферментов, т.е. действуют неспецифично.
В научной деятельности для более точного описания процессов ингибирования пользуются кинетикой Михаэлиса-Ментен и ее терминами - максимальная скорость (Vmax) и константа Михаэлиса (Km).
Ингибирование ферментов
Можно выделить два основных направления ингибирования
- по прочности связывания фермента с ингибитором ингибирование бывает обратимым и необратимым.
- по отношению ингибитора к активному центру фермента ингибирование делят на конкурентное и неконкурентное.
Необратимое ингибирование
При необратимом ингибировании происходит связывание или разрушение функциональных групп фермента, необходимых для проявления его активности.
Например, вещество диизопропилфторфосфат прочно и необратимо связывается с гидроксигруппой серина в активном центре фермента ацетилхолинэстеразы, гидролизующей ацетилхолин в нервных синапсах. Ингибирование этого фермента предотвращает распад ацетилхолина в синаптической щели, в результате чего медиатор продолжает оказывать воздействие на свои рецепторы, что бесконтрольно усиливает холинергическую регуляцию.
Аналогично диизопропилфторфосфат ингибирует химотрипсин и другие протеазы, имеющие в активном центре серин (сериновые протеазы).
Диизопропилфторфосфат относится к нервно-паралитическим ядам, аналогичным образом действуют боевые фосфоорганические вещества (зарин, зоман). Сюда же относится вещество "малатион", включенный в инсектициды (карбофос, дихлофос) и превращающийся в организме насекомых в ингибитор ацетилхолинэстеразы, а в организме животных и человека разрушающийся до безвредных продуктов.
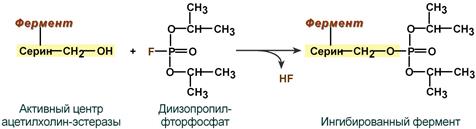
Механизм необратимого ингибирования ацетилхолинэстеразы
Еще один пример связан с ингибированием ацетилсалициловой кислотой (аспирином) ключевого фермента синтеза простагландинов – циклооксигеназы. Эта кислота входит в состав противовоспалительных средств и используется при воспалительных заболеваниях и лихорадочных состояниях. Присоединение ацетильной группы к гидроксильной группе серина в активном центре фермента вызывает инактивацию последнего и прекращение синтеза простагландинов.
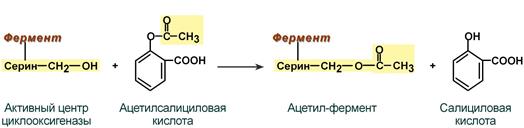
Механизм необратимого ингибирования циклооксигеназы
Третьим показательным примером необратимого ингибирования является влияние антибиотика пенициллина на фермент транспептидазу, сшивающую цепи пептидогликана как последний шаг в синтезе клеточной стенки бактерий.
Обратимое ингибирование
При обратимом ингибировании происходит непрочное связывание ингибитора с функциональными группами фермента, вследствие чего активность фермента постепенно восстанавливается.
Примером обратимого ингибитора может служить прозерин, связывающийся с ферментом ацетилхолинэстеразой в ее активном центре. Группа ингибиторов холинэстеразы (прозерин, дистигмин, галантамин) используется при миастении, после энцефалита, менингита, травм ЦНС.
Конкурентное ингибирование
При таком виде ингибирования ингибитор по своей структуре похож на субстрат фермента. Поэтому он соперничает с субстратом за активный центр (за контактный участок), что приводит к уменьшению связывания субстрата с ферментом и нарушению катализа. В этом состоит особенность конкурентного ингибирования – возможность усилить или ослабить ингибирование через изменение концентрации субстрата. При данном ингибировании максимальная скорость реакции остается вполне достижимой при создании высоких концентраций субстрата.
Например:
1. Ингибирование фермента цикла трикарбоновых кислот сукцинат-дегидрогеназы малоновой кислотой, структура которой схожа со структурой субстрата этого фермента – янтарной кислоты (сукцината).
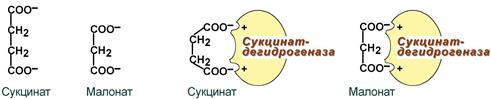
Конкурентное ингибирование сукцинатдегидрогеназы
2. Также к конкурентным ингибиторам относят антиметаболиты или псевдосубстраты, например, антибактериальные средства сульфаниламиды, схожие по структуре с пара-аминобензойной кислотой, компонентом фолиевой кислоты. При лечении сульфаниламидами в бактериальной клетке возникает конкуренция между сульфаниламидом и пара-аминобензойной кислотой при синтезе дигидрофолиевой кислоты, что и вызывает лечебный эффект.
3. В качестве других примеров лекарственных конкурентных ингибиторов можно привести
- ингибитор синтеза холестерина ловастатин, обратимо ингибирующий ГМГ-S-КоА-редуктазу,
- противоопухолевый препарат метотрексат, необратимо подавляющий дигидрофолатредуктазу,
- непрямой антикоагулянт дикумарол, конкурент витамина К,
- антигипертензивный препарат метил-ДОФА, подавляющий активность ДОФА-декарбоксилазы,
- средство для лечения подагры аллопуринол, ингибирующий ксантиноксидазу.
Неконкурентное ингибирование
Данный вид ингибирования связан с присоединением ингибитора не в активном центре, а в другом месте молекулы. Но при этом меняется структура активного центра и связь с субстратом становится невозможной. Это может быть аллостерическое ингибирование, когда активность фермента снижается естественными модуляторами, или связывание с ферментом каких-либо веществ вне активного и аллостерического центра. Например:
- синильная кислота (цианиды) связывается с гемовым железом ферментов дыхательной цепи и блокирует клеточное дыхание,
- связывание ионов тяжелых металлов (Cu2+, Hg2+, Ag+) с SH-группами белков.
Особенностью неконкурентного ингибитора является его способность связываться с ферментом независимо от субстрата, т.е. изменение концентрации субстрата никак не влияет на образование комплекса фермент-ингибитор.
Бесконкурентное ингибирование
В этом случае ингибитор связывается в активном центре с фермент-субстратным комплексом. Повышение концентрации субстрата, увеличивая количество фермент-субстратного комплекса, усиливает и связывание ингибитора с ним. Таким образом, бесконкурентное ингибирование более сложно, чем другие типы ингибирования.
На примере пенициллина также рассматривается т.н. суицидное ингибирование. При нем субстрат первоначально связывается с ферментом обратимо, а затем образует устойчивое ковалентное соединение с активным центром, что приводит к ингибированию активности фермента.
Смешанное ингибирование
При таком ингибировании ингибитор способен присоединяться везде – не только в активном центре, но и в других частях молекулы. Но после этого фермент еще способен частично сохранять свою активность. Примером является влияние мертиолата (ртутьорганическое вещество) на сахаразу грибов микромицетов для подавления их роста.
