Строение
Инсулин представляет собой белок, состоящий из двух пептидных цепей А (21 аминокислота) и В (30 аминокислот), связанных между собой дисульфидными мостиками. Всего в зрелом инсулине человека присутствует 51 аминокислота и его молекулярная масса равна 5,7 кДа.
Синтез
Инсулин синтезируется в β-клетках поджелудочной железы в виде препроинсулина, на N-конце которого находится концевая сигнальная последовательность из 23 аминокислот, служащая проводником всей молекулы в полость эндоплазматической сети. Здесь концевая последовательность сразу отщепляется и проинсулин транспортируется в аппарат Гольджи.
На данном этапе в молекуле проинсулина присутствуют А-цепь, В-цепь и С-пептид (англ. connecting – связующий). В аппарате Гольджи проинсулин упаковывается в секреторные гранулы вместе с ферментами, необходимыми для "созревания" гормона . По мере перемещения гранул к плазматической мембране образуются дисульфидные мостики, вырезается связующий С-пептид (31 аминокислота) и формируется готовая молекула инсулина. В готовых гранулах инсулин находится в кристаллическом состоянии в виде гексамера, образуемого с участием двух ионов Zn2+.
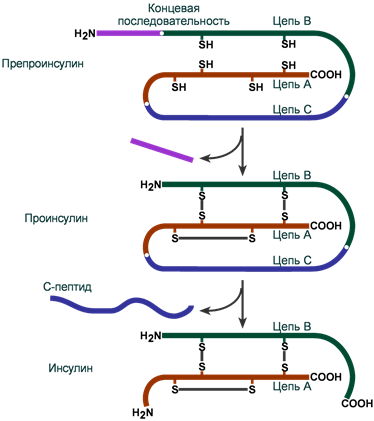
Схема синтеза инсулина
Регуляция синтеза и секреции
Секреция инсулина из β-клеток происходит постоянно, и высвобождение около 50% инсулина никак не связано с приемом пищи или иными влияниями. В течение суток поджелудочная железа выделяет примерно 1/5 от запасов имеющегося в ней инсулина.
Главным стимулятором секреции инсулина является повышение концентрации глюкозы в крови выше 5,5 ммоль/л, максимума секреция достигает при 17-28 ммоль/л. Особенностью этой стимуляции является двухфазное усиление секреции инсулина:
- первая фаза длится 5-10 минут и концентрация гормона может 10-кратно возрастать, после чего его количество понижается,
- вторая фаза начинается примерно через 15 минут от начала гипергликемии и продолжается на протяжении всего ее периода, приводя к увеличению уровня гормона в 15-25 раз.
Чем дольше в крови сохраняется высокая концентрация глюкозы, тем большее число β-клеток подключается к секреции инсулина.
Индукция синтеза инсулина происходит от момента проникновения глюкозы в клетку до трансляции инсулиновой мРНК. Она регулируется повышением транскрипции гена инсулина, повышением стабильности инсулиновой мРНК и увеличением трансляции инсулиновой мРНК.
Активация секреции инсулина
1. После проникновения глюкозы в β-клетки (через ГлюТ-1 и ГлюТ-2) она фосфорилируется гексокиназой IV (глюкокиназа, обладает низким сродством к глюкозе),
2. Далее глюкоза аэробно окисляется, при этом скорость окисления глюкозы линейно зависит от ее количества,
3. В результате нарабатывается АТФ, количество которого также прямо зависит от концентрации глюкозы в крови,
4. Накопление АТФ стимулирует закрытие ионных K+-каналов, что приводит к деполяризации мембраны,
5. Деполяризация мембраны приводит к открытию потенциал-зависимых Ca2+-каналов и притоку ионов Ca2+ в клетку,
6. Поступающие ионы Ca2+ активируют фосфолипазу C и запускают кальций-фосфолипидный механизм проведения сигнала с образованием ДАГ и инозитол-трифосфата (ИФ3),
7. Появление ИФ3 в цитозоле открывает Ca2+-каналы в эндоплазматической сети, что ускоряет накопление ионов Ca2+ в цитозоле,
8. Резкое увеличение концентрации в клетке ионов Ca2+ приводит к перемещению секреторных гранул к плазматической мембране, их слиянию с ней и экзоцитозу кристаллов зрелого инсулина наружу,
9. Далее происходит распад кристаллов, отделение ионов Zn2+ и выход молекул активного инсулина в кровоток.
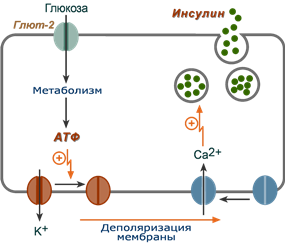
Схема внутриклеточной регуляции секреции инсулина при участии глюкозы
Описанный ведущий механизм может корректироваться в ту или иную сторону под действием ряда других факторов, таких как аминокислоты, жирные кислоты, гормоны ЖКТ и другие гормоны, нервная регуляция.
Из аминокислот на секрецию гормона наиболее значительно влияют лизин и аргинин. Но сами по себе они почти не стимулируют секрецию, их эффект зависит от наличия гипергликемии, т.е. аминокислоты только потенциируют действие глюкозы.
Свободные жирные кислоты также являются факторами, стимулирующими секрецию инсулина, но тоже только в присутствии глюкозы.
Логичной является положительная чувствительность секреции инсулина к действию гормонов желудочно-кишечного тракта – инкретинов (энтероглюкагона и глюкозозависимого инсулинотропного полипептида), холецистокинина, секретина, гастрина, желудочного ингибирующего полипептида.
Клинически важным и в какой-то мере опасным является усиление секреции инсулина при длительном воздействии соматотропного гормона, АКТГ и глюкокортикоидов, эстрогенов, прогестинов. При этом возрастает риск истощения β-клеток, уменьшение синтеза инсулина и возникновение инсулинзависимого сахарного диабета. Такое может наблюдаться при использовании указанных гормонов в терапии или при патологиях, связанных с их гиперфункцией.
Нервная регуляция β-клеток поджелудочной железы включает адренергическую и холинергическую регуляцию. Любые стрессы (эмоциональные и/или физические нагрузки, гипоксия, переохлаждение, травмы, ожоги) повышают активность симпатической нервной системы и подавляют секрецию инсулина за счет активации α2-адренорецепторов. С другой стороны, стимуляция β2-адренорецепторов приводит к усилению секреции.
Также выделение инсулина повышается n.vagus, в свою очередь находящегося под контролем гипоталамуса, чувствительного к концентрации глюкозы крови.
Мишени
Рецепторы инсулина находятся практически на всех клетках организма, кроме нервных, но в разном количестве. Нервные клетки не имеют рецепторов к инсулину, т.к. последний просто не проникает через гематоэнцефалический барьер.
Механизм действия
После связывания инсулина с рецептором активируется ферментативный домен рецептора. Так как он обладает тирозинкиназной активностью, то фосфорилирует внутриклеточные белки - субстраты инсулинового рецептора. Дальнейшее развитие событий обусловлено двумя направлениями: MAP-киназный путь и ФИ-3-киназный механизмы действия (подробно).
При активации фосфатидилинозитол-3-киназного механизма результатом являются быстрые эффекты – активация ГлюТ-4 и поступление глюкозы в клетку, изменение активности "метаболических" ферментов – ТАГ-липазы, гликогенсинтазы, гликогенфосфорилазы, киназы гликогенфосфорилазы, ацетил-SКоА-карбоксилазы и других.
При реализации MAP-киназного механизма (англ. MAP - mitogen-activated protein) регулируются медленные эффекты – пролиферация и дифференцировка клеток, процессы апоптоза и антиапоптоза.
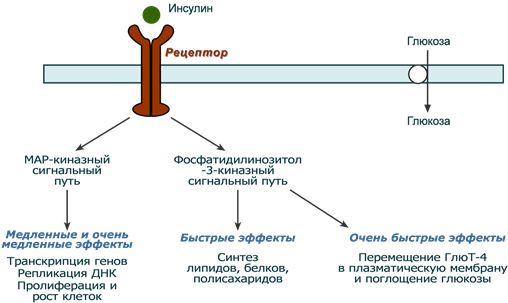
Два механизма действия инсулина
Скорость эффектов действия инсулина
Биологические эффекты инсулина подразделяются по скорости развития:
Очень быстрые эффекты (секунды)
Эти эффекты связаны с изменением трансмембранных транспортов:
1. Активации Na+/K+-АТФазы, что вызывает выход ионов Na+ и вход в клетку ионов K+, что ведет к гиперполяризации мембран чувствительных к инсулину клеток (кроме гепатоцитов).
2. Активация Na+/H+-обменника на цитоплазматической мембране многих клеток и выход из клетки ионов H+ в обмен на ионы Na+. Такое влияние имеет значение в патогенезе артериальной гипертензии при сахарном диабете 2 типа.
3. Угнетение мембранной Ca2+-АТФазы приводит к задержке ионов Ca2+ в цитозоле клетки.
4. Выход на мембрану миоцитов и адипоцитов переносчиков глюкозы ГлюТ-4 и увеличение в 20-50 раз объема транспорта глюкозы в клетку.
Быстрые эффекты (минуты)
Быстрые эффекты заключаются в изменении скоростей фосфорилирования и дефосфорилирования метаболических ферментов и регуляторных белков.
Печень
- торможение эффектов адреналина и глюкагона (активация фосфодиэстеразы),
- ускорение гликогеногенеза (гликогенсинтаза),
- активация гликолиза (фосфофруктокиназа, пируваткиназа),
- увеличение превращения пирувата в ацетил-SКоА (ПВК-дегидрогеназа),
- усиление синтеза жирных кислот (ацетил-SКоА-карбоксилаза),
- формирование ЛПОНП,
- повышение синтеза холестерина (ГМГ-SКоА-редуктаза),
Мышцы
- торможение эффектов адреналина (активация фосфодиэстеразы),
- стимулирует транспорт глюкозы в клетки (активация ГлюТ-4),
- стимуляция гликогеногенеза (гликогенсинтаза),
- активация гликолиза (фосфофруктокиназа, пируваткиназа),
- увеличение превращения пирувата в ацетил-SКоА (ПВК-дегидрогеназа),
- усиливает транспорт нейтральных аминокислот в мышцы,
- стимулирует трансляцию (рибосомальный синтез белков).
Жировая ткань
- стимулирует транспорт глюкозы в клетки (активация Глют-4),
- активирует запасание жирных кислот в тканях (липопротеинлипаза),
- активация гликолиза (фосфофруктокиназа, пируваткиназа),
- усиление синтеза жирных кислот (активация ацетил-SКоА-карбоксилазы),
- создание возможности для запасания ТАГ (инактивация гормон-чувствительной-липазы).
Медленные эффекты (минуты-часы)
Медленные эффекты заключаются в изменении скорости транскрипции генов белков, отвечающих за обмен веществ, за рост и деление клеток, например:
1. Индукция синтеза ферментов в печени
- глюкокиназы и пируваткиназы (гликолиз),
- АТФ-цитрат-лиазы, ацетил-SКоА-карбоксилазы, синтазы жирных кислот, цитозольной малатдегидрогеназы (синтез жирных кислот),
- глюкозо-6-фосфатдегидрогеназы (пентозофосфатный путь),
2. Индукция в адипоцитах синтеза глицеральдегидфосфат-дегидрогеназы и синтазы жирных кислот.
3. Репрессия синтеза мРНК, например, для ФЕП-карбоксикиназы (глюконеогенез).
4. Обеспечивает процессы трансляции, повышая фосфорилирование по серину рибосомального белка S6.
Очень медленные эффекты (часы-сутки)
Очень медленные эффекты реализуют митогенез и размножение клеток. Например, к этим эффектам относится
1. Повышение в печени синтеза соматомедина, зависимого от гормона роста.
2. Увеличение роста и пролиферации клеток в синергизме с соматомединами.
3. Переход клетки из G1-фазы в S-фазу клеточного цикла.
Инактивация инсулина
Удаление инсулина из циркуляции происходит после его связывания с рецептором и последующей интернализации (эндоцитоза) гормон-рецепторного комплекса, в основном в печени и мышцах. После поглощения комплекс разрушается и белковые молекулы лизируются до свободных аминокислот. В печени захватывается и разрушается до 50% инсулина при первом прохождении крови, оттекающей от поджелудочной железы. В почках инсулин фильтруется в первичную мочу и, после реабсорбции в проксимальных канальцах, разрушается.
Патология
Гипофункция
Инсулинзависимый и инсулиннезависимый сахарный диабет. Для диагностики этих патологий в клинике активно используют нагрузочные пробы и определение концентрации инсулина и С-пептида.
