Активация кислорода происходит по двум различным механизмам: под воздействием физических или химических (ферментативных или спонтанных) стимулов.
1. Физическая активация
Физическая активация - это поглощение молекулой O2 достаточного количества энергии (магнитное поле, излучение, электрический разряд), чтобы изменить спин одного из неспаренных электронов. При этом образуется синглетный кислород.
Когда кислород находится в основном, триплетном состоянии, его электроны имеют параллельные спины. Если триплет кислорода поглощает энергию, достаточную для изменения спина одного из своих неспаренных электронов, он превращается в синглетную форму, в которой оба электрона имеют противоположные спины.
Синглетный кислород может уже участвовать в реакциях с одновременной передачей двух электронов. Поскольку спаренные электроны распространены в органических молекулах, синглетный кислород гораздо более реакционноспособен, чем его триплетный аналог.
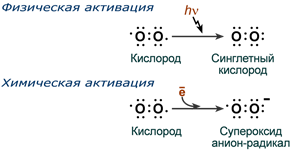
Два способа активации кислорода
2. Химическая активация
Химических активация - это получение молекулой кислорода электронов из каких-либо химических источников (восстановителей).
В многочисленных реакциях восстановления молекулы O2 в качестве промежуточных метаболитов появляются активные формы кислорода и его радикалы. В конце восстановительного пути кислород превращается в воду.

Общая схема процесса восстановления кислорода до воды
Реакции одноэлектронного восстановления кислорода
Принимая первый электрон, молекула кислорода превращается в супероксид анион-радикал О2ꜙ , при дальнейшем восстановлении происходит присоединение либо иона H+ с появлением гидропероксид радикала HO2•, либо электрона с образованием пероксид аниона O22–. В следующем шаге восстановления, наоборот, присоединяется либо электрон, либо ион H+ и образуется гидропероксид анион HO2–, который далее восстанавливается до пероксида водорода H2O2.
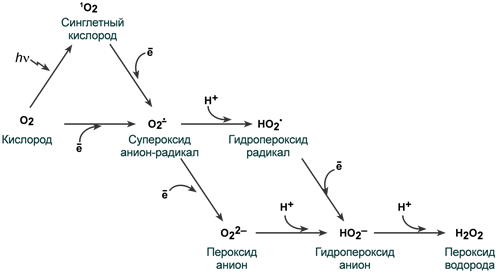
Пошаговое представление реакций восстановления молекулы кислорода
до пероксида водорода
Пероксид водорода является нейтральным соединением и поэтому легко проходит через клеточные мембраны. Ковалентная связь между атомами кислорода в H2O2 может разрываться при воздействии ионизирующего или ультрафиолетового излучения, при спонтанном взаимодействии с ионом железа Fe2+ (реакция Фентона) или с супероксид анион-радикалом (реакция Haber-Weiss, Хабера-Вайса, Габера-Вейса).

Реакции образования гидроксил-радикала
При физиологических условиях реакция Хабера-Вайса идет крайне медленно, но ее способны ускорять металлы с переменной валентностью (железо Fe2+/Fe3+, медь Cu+/Cu2+):

