Третичная структура – это укладка полипептидной цепи в глобулу ("клубок"). Четкой границы между вторичной и третичной структурами провести нельзя, однако в основе третичной структуры лежат взаимосвязи между радикалами аминокислот, отстоящими далеко друг от друга в цепи. Благодаря третичной структуре происходит еще более компактная укладка белковой цепи.
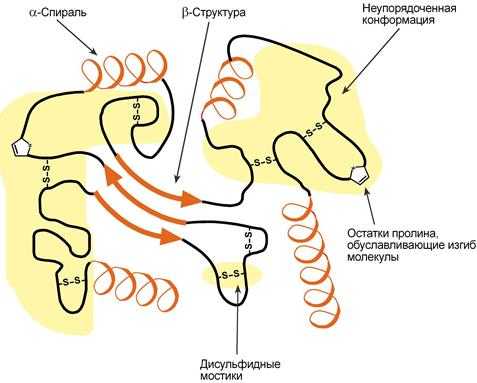
Схематичное представление укладки белка в третичную структуру
Наряду с α-спиралью и β-структурой в третичной структуре обнаруживается так называемая неупорядоченная конформация, которая может занимать значительную часть молекулы. В разных белках наблюдается разное соотношение типов структур. Например, инсулин содержит 52% α-спирали и 6% β-структуры, трипсин – 14% α-спирали и 45% β-структуры.
Аминокислоты принимают участие в формировании третичной структуры, образуя связи своими функциональными группами (радикалами), например:
- водородные – между НО-, СООН-, NH2-группами радикалов аминокислот,
- дисульфидные – между остатками цистеина,
- гидрофобные – между остатками алифатических и ароматических аминокислот,
- ионные – между СОО–-группами глутамата и аспартата и NH3+-группами лизина и аргинина,
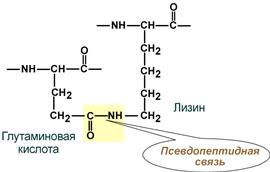
- псевдопептидные – между дополнительными СОО–-группами глутамата и аспартата и дополнительными NH3+-группами лизина и аргинина.
Существует препарат ацетилцистеин, способный разрывать внутри- и межмолекулярные дисульфидные связи белков мокроты, что приводит к деполимеризации мукопротеидов и уменьшению ее вязкости.
