Буферные системы
Буферные системы – это соединения, противодействующие резким изменениям концентрации ионов Н+. Любая буферная система - это кислотно-основная пара: слабое основание (анион, А–) и слабая кислота (Н-Анион, H-А). Они минимизируют сдвиги количества ионов Н+ в растворе за счет их связывания с анионом и включения в плохо диссоциирующее соединение – в слабую кислоту. Поэтому общее количество ионов Н+ изменяется не так заметно, как это могло бы быть.
Существует три буферные системы жидкостей организма – бикарбонатная, фосфатная, белковая (включая гемоглобиновую).Они вступают в действие моментально и через несколько минут их эффект достигает максимума возможного.
Фосфатная буферная система
Фосфатная буферная система составляет около 2% от всей буферной емкости крови и до 50% буферной емкости мочи. Она образована гидрофосфатом (HPO42–) и дигидрофосфатом (H2PO4–). Дигидрофосфат слабо диссоциирует и ведет себя как слабая кислота, гидрофосфат обладает щелочными свойствами. В норме отношение HРO42– к H2РO4– равно 4 : 1.
При взаимодействии кислот (ионов Н+) с двузамещенным фосфатом (HPO42‑) образуется дигидрофосфат (H2PO4–):
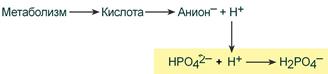
Удаление ионов H+ фосфатным буфером
В результате концентрация ионов Н+ понижается.
При поступлении в кровь оснований (избыток ОН–‑групп) они нейтрализуются поступающими в плазму от H2PO4– ионами Н+:
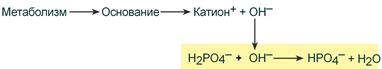
Удаление щелочных эквивалентов фосфатным буфером
Роль фосфатного буфера особенно высока во внутриклеточном пространстве и в просвете почечных канальцев. Кислотно-основная реакция мочи зависит только от содержания дигидрофосфата (H2PO4–), т.к. бикарбонат натрия в почечных канальцах реабсорбируется.
Бикарбонатная буферная система
Эта система самая мощная, на ее долю приходится 65% всей буферной мощности крови. Она состоит из бикарбонат-иона (НСО3–) и угольной кислоты (Н2СО3). В норме отношение HCO3– к H2CO3 равно 20 : 1.
При поступлении в кровь ионов H+ (т.е. кислоты) ионы бикарбоната натрия взаимодействуют с ней и образуется угольная кислота:
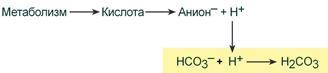
При работе бикарбонатной системы концентрация водородных ионов понижается, т.к. угольная кислота является очень слабой кислотой и плохо диссоциирует. При этом в крови не происходит параллельного значимого увеличения концентрации НСО3–.
Если в кровь поступают вещества с щелочными свойствами, то они реагируют с угольной кислотой и образуют ионы бикарбоната:
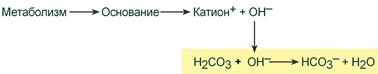
Работа бикарбонатного буфера неразрывно связана с дыхательной системой (с вентиляцией легких). В легочных артериолах при снижении плазменной концентрации СО2 и благодаря присутствию в эритроцитах фермента карбоангидразы угольная кислота быстро расщепляется с образованием CO2, удаляемого с выдыхаемым воздухом:
Н2СО3→ Н2О + СО2↑
Кроме эритроцитов, значительная активность карбоангидразы отмечена в эпителии почечных канальцев, клетках слизистой оболочки желудка, коре надпочечников и клетках печени, в незначительных количествах – в центральной нервной системе, поджелудочной железе и других органах.
Белковая буферная система
Белки плазмы, в первую очередь альбумин, играют роль буфера благодаря своим амфотерным свойствам. Их вклад в буферизацию плазмы крови около 5%.
В кислой среде подавляется диссоциация СООН‑групп аминокислотных радикалов (в аспарагиновой и глутаминовой кислотах), а группы NH2 (в аргинине и лизине) связывают избыток Н+. При этом белок заряжается положительно.
В щелочной среде усиливается диссоциация COOH‑групп, поступающие в плазму ионы Н+ связывают избыток ОН–‑ионов и pH сохраняется. Белки в данном случае выступают как кислоты и заряжаются отрицательно.
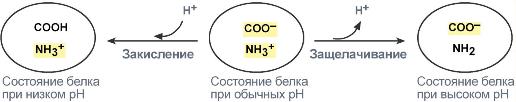
Изменение заряда буферных групп белка при различных рН
Гемоглобиновая буферная система
Высокой мощностью в крови обладает гемоглобиновый буфер, на него приходится до 28% всей буферной емкости крови. В качестве кислой части буфера выступает оксигенированный гемоглобин H‑HbO2. Он имеет выраженные кислотные свойства и в 80 раз легче отдает ионы водорода, чем восстановленный Н‑Нb, выступающий как основание. Гемоглобиновый буфер можно рассматривать как часть белкового, но его особенностью является работа в теснейшем контакте с бикарбонатной системой.
Изменение кислотности гемоглобина происходит в тканях и в легких, и вызывается связыванием соответственно H+ или О2. Непосредственный механизм действия буфера заключается в присоединении или отдаче иона H+ остатком гистидина в глобиновой части молекулы (эффект Бора).
В тканях более кислый pH в норме является результатом накопления минеральных (угольной, серной, соляной) и органических кислот (молочной). При компенсации pH данным буфером ионы H+ присоединяются к пришедшему оксигемоглобину (HbО2) и превращают его в H‑HbО2. Это моментально вызывает отдачу оксигемоглобином кислорода (эффект Бора) и он превращается в восстановленный H‑Hb.
НbO2+ Н+ → [H-HbO2] → Н-Hb + O2
В результате снижается количество кислот, в первую очередь Н2СО3, продуцируются ионы НСО3‑ и тканевое пространство подщелачивается.
В легких после удаления СО2 (угольной кислоты) происходит защелачивание крови. При этом присоединение О2 к дезоксигемоглобину H-Hb образует кислоту более сильную, чем угольная. Она отдает свои ионы Н+ в среду, предотвращая повышение рН:
Н-Hb + O2 → [H-HbO2] → НbO2 + Н+
Работу гемоглобинового буфера рассматривают неотрывно от бикарбонатного буфера:
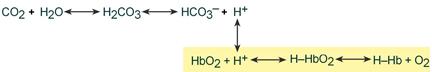
Эффективность гемоглобинового буфера напрямую зависит от активности дыхательной системы (Газообмен в легких и тканях).
