Активность ферментов в клетке непостоянна во времени. Ферменты чутко реагируют на ситуацию, в которой оказывается клетка, на факторы, воздействующие на нее как снаружи, так и изнутри. Главная цель такой чувствительности ферментов – отреагировать на изменение окружающей среды, приспособить клетку к новым условиям, дать должный ответ на гормональные и иные стимулы, а в некоторых ситуациях – предоставить клетке шанс выжить.
Способы регуляции активности ферментов
В клетке имеется несколько способов регуляции активности ферментов – одни способы подходят для любых ферментов, другие более специфичны.
1.Доступность субстрата или кофермента
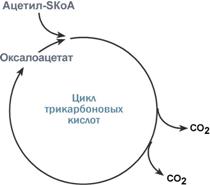
Роль оксалоацетата для работы ЦТК |
Здесь работает закон действия масс – фундаментальный закон химической кинетики: при постоянной температуре скорость химической реакции пропорциональна произведению концентрации реагирующих веществ. Или упрощенно – скорость, с которой вещества реагируют друг с другом, зависит от их концентрации. Таким образом, изменение количества хотя бы одного из субстратов прекращает или начинает реакцию.
Например, для цикла трикарбоновых кислот (ЦТК) таким субстратом является оксалоацетат (щавелевоуксусная кислота). Наличие оксалоацетата "подталкивает" реакции цикла, что позволяет вовлекать в окисление молекулы ацетил-SКоА.
2. Компартментализация
Компартментализация – это сосредоточение ферментов и их субстратов в одном компартменте (одной органелле) – в эндоплазматическом ретикулуме, митохондриях, лизосомах, ядре, плазматической мембране и т.п.
Например, ферменты цикла трикарбоновых кислот и β-окисления жирных кислот расположены в митохондриях, ферменты синтеза белка – в рибосомах.
3. Генетическая регуляция
Генетическая регуляция (изменение количества фермента) может происходить в результате увеличения или снижения его синтеза. С этой точки зрения ферменты можно подразделить на три группы:
- Конституитивные – такие ферменты, которые образуются в клетке постоянно, независимо от наличия субстрата (нейрональная NO-синтаза, ферменты гликолиза, β-окисления жирных кислот, репарации ДНК).
- Индуцируемые – синтез этих ферментов возрастает при наличии соответствующих стимулов - индукторов.
- Репрессируемые – образование таких ферментов в клетке при необходимости подавляется.
Изменение скорости синтеза фермента (индукция или репрессия) обычно зависит от количества определенных гормонов или метаболитов процесса.
Примеры индуцируемых ферментов:
- гормоны глюкокортикоиды стимулируют синтез ферментов глюконеогенеза, что обеспечивает стабильность концентрации глюкозы в крови при длительном голоданиии и устойчивость ЦНС к стрессу,
- исчезновение пищеварительных ферментов при длительном голодании и индукция их синтеза в восстановительный период в результате возобновления секреции гормонов ЖКТ,
- при беременности и после родов в молочной железе индуцируется синтез фермента лактозосинтазы под воздействием лактотропного гормона,
- токсические субстраты (например, этанол и барбитураты) стимулируют в печени синтез "своего" изофермента цитохрома Р450, который окисляет и обезвреживает эти вещества,
- при активации цитокинами моноцитов и макрофагов в них начинается синтез индуцируемой NO-синтазы.
Примеры репрессируемых ферментов:
- в печени репрессия фермента синтеза холестерола ГМГ-SKoA-редуктазы под влиянием холестерина и желчных кислот,
- в печени репрессия синтеза ферментов глюконеогенеза под действием инсулина,
- подавление синтеза триптофана бактериями при деятельности триптофанового оперона.
4. Ограниченный (частичный) протеолиз проферментов
Ограниченный (частичный) протеолиз проферментов подразумевает, что синтез некоторых ферментов осуществляется в виде более крупного предшественника и при поступлении в нужное место этот фермент активируется через отщепление от него одного или нескольких пептидных фрагментов. Подобный механизм защищает внутриклеточные структуры от повреждений.
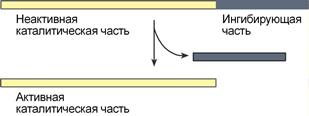
Схема активации фермента способом
"ограниченного протеолиза"
Примером служит активация протеолитических ферментов желудочно-кишечного тракта (трипсиноген, пепсиноген, прокарбоксипептидазы), факторов свертывающей системы крови, лизосомальных ферментов (катепсины).
Секреция ряда ферментов за пределы клетки в неактивном состоянии позволяет предохранить клетки от повреждения (пищеварительные ферменты) или сохранить белок в плазме крови до наступления определенного момента (факторы свертывания крови, белки системы комплемента, калликреин-кининовой и ренин-ангиотензиновой систем).
5. Аллостерическая регуляция
Аллостерические ферменты построены из двух и более субъединиц: одни субъединицы содержат каталитический центр, другие имеют аллостерический центр и являются регуляторными. Присоединение эффектора к аллостерической (регуляторной) субъединице изменяет конформацию белка и, соответственно, активность каталитической субъединицы.
Аллостерические ферменты обычно стоят в начале метаболических путей, и от их активности зависит течение многих последующих реакций. Поэтому они часто называются ключевыми ферментами.
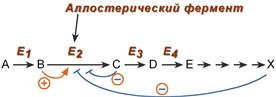
Общий принцип аллостерической регуляции
В качестве отрицательного регулятора может выступать конечный или промежуточный метаболит биохимического процесса или продукт данной реакции, т.е включается механизм обратной отрицательной связи. Если регуляторами являются начальный метаболит или субстрат реакции, то говорят о прямой регуляции, она может быть как положительной, так и отрицательной. Также регулятором могут быть метаболиты биохимических путей, каким то образом связанных с данной реакцией.
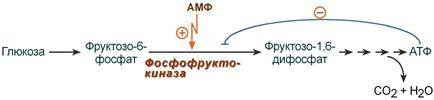
Регуляция фосфофруктокиназы конечным продуктом
Например, фермент энергетического окисления глюкозы, фосфофруктокиназа, регулируется промежуточными и конечными продуктами этого распада. При этом АТФ, лимонная кислота, фруктозо-1,6-дифосфат являются ингибиторами, а фруктозо-6-фосфат и АМФ – активаторами фермента.
Еще примеры:
- В большинстве клеток организма (кроме печени) при регуляции синтеза холестерола аллостерическим ингибитором ключевого фермента этого процесса ГМГ-КоА-редуктазы выступает сам холестерол, что быстро и точно регулирует его количество,
- Фермент ЦТК изоцитрат-дегидрогеназа активируется при помощи АМФ и АДФ и ингибируется влияниями АТФ и НАДН.
6. Белок-белковое взаимодействие
Термин белок-белковое взаимодействие обозначает ситуацию, когда в качестве регулятора выступают не метаболиты биохимических процессов, а специфичные белки. В целом ситуация схожа с аллостерическим механизмом: после влияния каких-либо факторов на специфичные белки изменяется активность этих белков, и они, в свою очередь, воздействуют на нужный фермент.
1. К примеру, мембранный фермент аденилатциклаза является чувствительным к воздействию мембранного G-белка, который сам активируется при действии на клетку некоторых гормонов (например, адреналина и глюкагона).
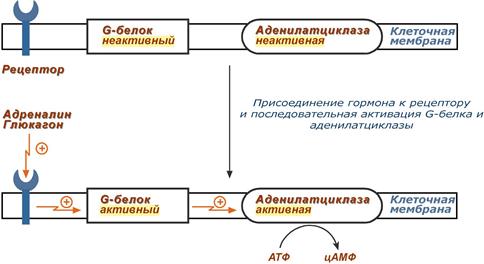
Упрощенная схема активации аденилатциклазы
Более подробно механизм активации G-белка можно посмотреть здесь.
2. Еще примером белок-белкового взаимодействия может быть регуляция активности протеинкиназы А через механизм ассоциации-диссоциации.
Протеинкиназа А является тетрамерным ферментом, состоящим из 2 каталитических (С) и 2 регуляторных (R) субъединиц. Активатором для протеинкиназы А является цАМФ. Присоединение цАМФ к регуляторным субъединицам фермента вызывает их отхождение от каталитических субъединиц. Каталитические субъединицы при этом активируются.
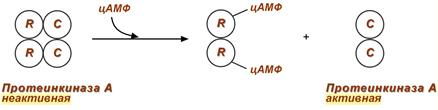
Активация протеинкиназы А при помощи цАМФ
7. Ковалентная (химическая) модификация
Ковалентная модификация заключается в обратимом присоединении или отщеплении определенной группы, благодаря чему изменяется активность фермента. Чаще всего такой группой является фосфорная кислота, реже метильные и ацетильные группы. Фосфорилирование фермента происходит по остаткам серина и тирозина. Присоединение фосфорной кислоты к белку осуществляют ферменты протеинкиназы, отщепление – протеинфосфатазы.
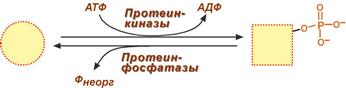
Изменение активности фермента
при фосфорилировании-дефосфорилировании
Ферменты могут быть активны как в фосфорилированном, так и в дефосфорилированном состоянии.
Например, в мышцах ферменты гликогенфосфорилаза и гликогенсинтаза
- при нагрузке фосфорилируются, при этом фосфорилаза гликогена становится активной и начинает расщепление гликогена и сжигание глюкозы, а гликогенсинтаза при этом неактивна.
- во время отдыха при синтезе гликогена оба фермента дефосфорилируются, синтаза при этом становится активной, фосфорилаза – неактивной.
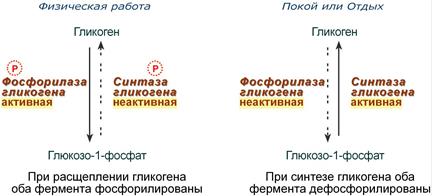
Зависимость активности ферментов обмена
гликогена от наличия в структуре фосфорной кислоты
