Структура простых белков представлена только полипептидной цепью (альбумин, инсулин). Однако необходимо понимать, что многие простые белки (например, альбумин) не существуют в "чистом" виде, они всегда связаны с какими-либо небелковыми веществами. Их относят к простым белкам только по той причине, что связи с небелковой группой слабые и при выделении in vitro они оказываются свободным от других молекул - простым белком.
Альбумины
Альбумины – это группа схожих белков плазмы крови с молекулярной массой 69 кДа, содержат много глутаминовой кислоты и поэтому имеют кислые свойства и высокий отрицательный заряд при физиологических рН. Легко адсорбируют полярные и неполярные молекулы, являются белком-транспортером в крови для многих веществ, в первую очередь для билирубина и длинноцепочечных жирных кислот.
Глобулины
Группа разнообразных белков плазмы крови с молекулярной массой до 100 кДа, слабокислые или нейтральные. Они слабо гидратированы, по сравнению с альбуминами меньше устойчивы в растворе и легче осаждаются, что используется в клинической диагностике в "осадочных" пробах (тимоловая, Вельтмана). Несмотря на то, что их обычно относят к простым, многие глобулины содержат углеводные или иные небелковые компоненты.
При электрофорезе глобулины сыворотки крови разделяются, как минимум, на 4 фракции – α1-глобулины, α2-глобулины, β-глобулины и γ-глобулины.
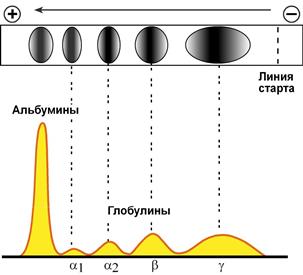
Картина электрофореграммы (вверху) белков сыворотки крови
и полученной на ее основе протеинограммы (внизу)
Так как глобулины включают в себя разнообразные белки, то их функции разнообразны:
Часть α-глобулинов обладает антипротеазной активностью, что защищает белки крови и межклеточного матрикса от преждевременного разрушения, например, α1-антитрипсин, α1-антихимотрипсин, α2-макроглобулин.
Некоторые глобулины способны к связыванию определенных веществ: трансферрин (переносит ионы железа), церулоплазмин (содержит ионы меди), гаптоглобин (переносчик гемоглобина), гемопексин (транспорт гема).
γ-Глобулины являются антителами и обеспечивают иммунную защиту организма.
Гистоны
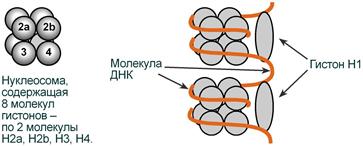
Взаимодействие гистонов и ДНК |
Гистоны – внутриядерные белки массой около 24 кДа. Обладают выраженными основными свойствами, поэтому при физиологических значениях рН заряжены положительно и связываются с дезоксирибо-нуклеиновой кислотой (ДНК), образуя дезоксирибо-нуклеопротеины. Существуют 5 типов гистонов – очень богатый лизином (29%) гистон Н1, другие гистоны Н2а, H2b, НЗ, Н4 богаты лизином и аргинином (в сумме до 25%).
Радикалы аминокислот в составе гистонов могут быть метилированы, ацетилированы или фосфорилированы. Это изменяет суммарный заряд и другие свойства белков.
Можно выделить две функции гистонов:
1. Регуляция активности генома, а именно – они препятствуют транскрипции.
2. Структурная – стабилизируют пространственную структуру ДНК.
Гистоны в комплексе с ДНК образуют нуклеосомы – октаэдрические структуры, составленные из гистонов Н2а, H2b, НЗ, Н4. Гистон H1 связан с молекулой ДНК, не позволяя ей "соскользнуть" с гистонового октамера. ДНК обвивает нуклеосому 2,5 раза, после чего обвивает следующую нуклеосому. Благодаря такой укладке достигается уменьшение размеров ДНК в 7 раз.
Далее такие "бусы" нуклеосом могут складываться в суперспираль и в более сложную структуру нуклеопротеина.
Благодаря гистонам и формированию более сложных структур размеры ДНК, в конечном итоге, уменьшаются в тысячи раз: на самом деле длина ДНК достигает 6-9 см (10–1), а размеры хромосом – всего несколько микрометров (10–6).
Протамины
Это белки массой от 4 кДа до 12 кДа, имеются в ядрах сперматозоидов многих организмов, в сперме рыб (молóках) они составляют основную массу белка. Протамины являются заменителями гистонов и служат для организации хроматина в спермиях. По сравнению с гистонами протамины отличаются резко увеличенным содержанием аргинина (до 80%). Также, в отличие от гистонов, протамины обладают только структурной функцией, регулирующей функции у них нет, хроматин в сперматозоидах неактивен.
Коллаген
Коллаген – фибриллярный белок с уникальной структурой, составляет основу межклеточного вещества соединительной ткани сухожилий, кости, хряща, кожи, но имеется, конечно, и в других тканях.
Полипептидная цепь коллагена включает 1000 аминокислот и носит название α-цепь. Насчитывается около 30 вариантов α-цепи коллагена, но все они обладают одним общим признаком – в большей или меньшей степени включают повторяющийся триплет [Гли-Х-Y], где X и Y – любые, кроме глицина, аминокислоты. В положении X чаще находится пролин или, гораздо реже, 3-оксипролин, в положении Y встречается пролин и 4-оксипролин. Также в положении Y часто находится аланин, лизин и 5-оксилизин. На другие аминокислоты приходится около трети от всего количества аминокислот.
Жесткая циклическая структура пролина и оксипролина не позволяет образовать правозакрученную α-спираль, но образует т.н. "пролиновый излом". Благодаря такому излому формируется левозакрученная спираль, где на один виток приходится 3 аминокислотных остатка.
При синтезе коллагена первостепенное значение имеет гидроксилирование лизина и пролина, включенных в состав первичной цепи, осуществляемое при участии аскорбиновой кислоты. Также коллаген обычно содержит моносахаридные (галактоза) и дисахаридные (глюкоза-галактоза) молекулы, связанные с ОН-группами некоторых остатков оксилизина.
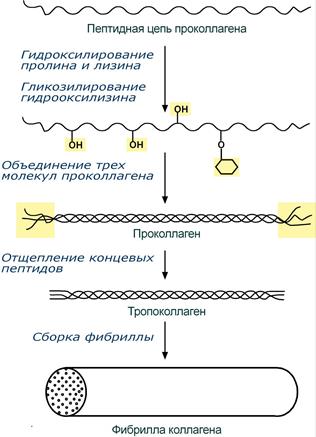
Этапы синтеза молекулы коллагена
Синтезированная молекула коллагена построена из 3 полипептидных цепей, сплетенных между собой в плотный жгут – тропоколлаген (длина 300 нм, диаметр 1,6 нм). Полипептидные цепи прочно связаны между собой через ε-аминогруппы остатков лизина. Тропоколлаген формирует крупные коллагеновые фибриллы диаметром 10-300 нм. Поперечная исчерченность фибриллы обусловлена смещением молекул тропоколлагена друг относительно друга на 1/4 их длины.
Фибриллы коллагена очень прочны, они прочнее стальной проволоки равного сечения. В коже фибриллы образуют нерегулярно сплетенную и очень густую сеть. Например, выделанная кожа представляет собой почти чистый коллаген.
Гидроксилирование пролина осуществляет железо-содержащий фермент пролилгидроксилаза для которого необходим витамин С (аскорбиновая кислота). Аскорбиновая кислота предохраняет от инактивации пролилгидроксилазу, поддерживая восстановленное состояние атома железа в ферменте. Коллаген, синтезированный в отсутствии аскорбиновой кислоты, оказывается недостаточно гидроксилированным и не может образовывать нормальные по структуре волокна, что приводит к поражению кожи и ломкости сосудов, и проявляется как цинга.
Гидроксилирование лизина осуществляет фермент лизилгидроксилаза. Она чувствительна к влиянию гомогентизиновой кислоты (метаболит тирозина), при накоплении которой (заболевания алкаптонурия) нарушается синтез коллагена, и развиваются артрозы.
Время полужизни коллагена исчисляется неделями и месяцами. Ключевую роль в его обмене играет коллагеназа, расщепляющая тропоколлаген на 1/4 расстояния с С-конца между глицином и лейцином.
По мере старения организма в тропоколлагене образуется все большее число поперечных связей, что делает фибриллы коллагена в соединительной ткани более жесткими и хрупкими. Это ведет к повышенной ломкости кости и снижению прозрачности роговицы глаза в старческом возрасте.
В результате распада коллагена образуется гидроксипролин. При поражении соединительной ткани (болезнь Пейджета, гиперпаратиреоидизм) экскреция гидроксипролина возрастает и имеет диагностическое значение.
Эластин
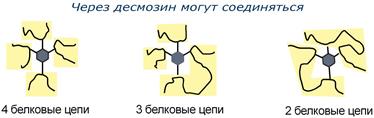
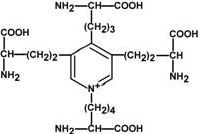 Строение десмозина |
По строению в общих чертах эластин схож с коллагеном. Находится в связках, эластичном слое сосудов. Структурной единицей является тропоэластин с молекулярной массой 72 кДа и длиной 800 аминокислотных остатков. В нем гораздо больше лизина, валина, аланина и меньше гидроксипролина. Отсутствие пролина обусловливает наличие спиральных эластичных участков.
Характерной особенностью эластина является наличие своеобразной структуры – десмозина, который своими 4-мя группами объединяет белковые цепи в системы, способные растягиваться во всех направлениях.
α-Аминогруппы и α-карбоксильные группы десмозина включаются в пептидные связи одной или нескольких белковых цепей.